Diagnoza nowotworu złośliwego zawsze wiąże się z silnymi emocjami dla pacjenta oraz jego najbliższych. Jednym z pierwszych pytań, które przychodzi do głowy jest „Ile czasu mi jeszcze zostało?”. Biorąc pod uwagę złożoność tematu, liczne czynniki wpływające na przeżycie oraz czas pracy lekarzy, trudno w kompleksowy i wyczerpujący sposób udzielić odpowiedzi na to pytanie w gabinecie lekarskim. Jednocześnie należy podkreślić, iż na ten moment nie dysponujemy wiedzą, pozwalającą precyzyjnie określić długość życia. Indywidualne cechy każdego pacjenta w znaczny sposób wpływają na przebieg choroby, proces leczenia oraz przeżycie. Mamy jednak dostęp do danych statystycznych uzyskanych z licznych badań naukowych, które drobiazgowo analizują wskaźniki przeżycia w chorobach nowotworowych. Rzucają one światło na skomplikowany i wzbudzający emocje temat rokowania w onkologii. Celem niniejszego artykułu jest zmierzenie się z tym trudnym tematem, rzetelnie i kompleksowo analizując dostępne dane w literaturze naukowej.
Rak jelita grubego jest jednym z najczęściej występujących nowotworów złośliwych. Według aktualnych danych epidemiologicznych, jest on trzecim najczęstszym nowotworem złośliwym na świecie, będąc jednocześnie drugą najczęstszą przyczyną zgonów z powodu nowotworów (1). W Polsce diagnozę słyszy średnio 16,8 tysięcy osób rocznie (2). Pomimo częstego występowania i agresywnego charakteru choroby, współczesna medycyna oferuje nowoczesne metody diagnostyki i leczenia, które w znaczny sposób poprawiają jakość oraz długość życia pacjentów. Zauważmy, że wyniki leczenia pacjentów z rakiem jelita grubego poprawiły się na przestrzeni ostatnich lat (3-5).
Rak jelita grubego – podstawowe informacje i statystyki
przeżywalności
Klasycznie nowotwory dzielimy na łagodne, złośliwe oraz takie o miejscowej złośliwości. Zmiany łagodne tworzą guzy zbudowane z komórek, które nie naciekają okolicznych tkanek oraz nie rozprzestrzeniają się do innych regionów organizmu, czyli nie dają przerzutów. Nowotwory złośliwe, czyli raki lub mięsaki, charakteryzują się szybkim wzrostem, inwazją w okoliczne tkanki oraz zdolnością do dawania przerzutów. Komórki nowotworów złośliwych różnią się od tych zdrowych; zaczynają się w niekontrolowany sposób dzielić i rozwijają oporność na śmierć (6).
Rak jelita grubego zbudowany jest z komórek nabłonka, który od wewnątrz wyścieła jelito grube. Najczęściej powstaje w wyniku przekształcenia gruczolaka, zmiany łagodnej, która także swoje źródło bierze ze struktur nabłonkowych. Gruczolaki budują powszechnie występujące polipy. Dlatego właśnie zespoły chorobowe związane z mnogim występowaniem polipów, jak na przykład rodzinna polipowatość gruczolakowata, znacznie zwiększają ryzyko wystąpienia raka jelita grubego (7). Tutaj należy wspomnieć o niezwykle ważnej roli kolonoskopii, badaniu endoskopowym, które umożliwia zobrazowanie wnętrza jelita grubego i usunięcie polipów, zapobiegając w ten sposób przekształceniu gruczolaka w gruczolakoraka, czyli raka jelita grubego.
Przeżywalność w onkologii oceniamy za pomocą tak zwanych krzywych przeżywalności, znanych także jako krzywe Kaplana-Meiera. Są to wykresy, które przedstawiają nam prawdopodobieństwo przeżycia w określonym czasie dla danej populacji. Za pomocą krzywych jesteśmy w stanie ocenić takie parametry jak 1, 3, czy 5-letnie przeżycie całkowite i przeżycie wolne od progresji. Przeżycie całkowite bierze pod uwagę zgony z dowolnych przyczyn i informuje nas o przeżyciu ogólnym. Wskaźnik ten możemy zawęzić do zgonów związanych wyłącznie z nowotworem. Przeżycie wolne od progresji z kolei informuje nas o prawdopodobieństwie przeżycia bez przyspieszenia rozwoju choroby, które określamy jako progresja choroby nowotworowej. W onkologicznych badaniach klinicznych wskaźnik mówi nam o tym, która terapia skuteczniej ogranicza rozwój choroby. Kolejnym istotnym parametrem jest mediana przeżycia, która informuje o czasie, w jakim doszło do zgonu połowy analizowanej populacji. Jeżeli badanie wykazało, że mediana przeżycia wynosi 4 lata, oznacza to, że połowa uczestników badania zmarła po 4 latach. Znajomość powyższych wskaźników pozwala nam analizować badania kliniczne pod względem przeżywalności. Pamiętajmy jednak, że przedstawione wskaźniki są wynikiem testów statystycznych, które zakładają margines błędu oraz nie odnoszą się do konkretnych jednostek, lecz całej populacji analizowanej w badaniu.
Wskaźniki używane przy ocenie przeżycia pacjentów
Znając już najważniejsze pojęcia, możemy przejść do omówienia ogólnych statystyk przeżywalności w raku jelita grubego. Według raportu Krajowego Rejestru Nowotworów oraz raportu otwarcia Narodowej Strategii Onkologicznej 5-letnie przeżycie chorych z rakiem jelita grubego mieści się w granicach 53,8% a 56,6% (8, 9). Należy przy tym zaznaczyć, że te dane są zbiorcze, nie biorą pod uwagę różnic w zaawansowaniu choroby ani licznych czynników, które mają wpływ na przeżycie.
Wskaźniki używane przy ocenie przeżycia pacjentów w badaniach onkologicznych
- Przeżycie całkowite
- Przeżycie wolne od progresji
- Mediana przeżycia
Ramka 1. Główne wskaźniki dotyczące przeżycia analizowane w badaniach onkologicznych.
Czynniki wpływające na długość życia z rakiem jelita grubego
Czynniki, które wpływają na przeżycie nazywamy czynnikami prognostycznymi. Parametry, które definiują nam wybór najbardziej korzystnej terapii określamy jako czynniki predykcyjne. Nierzadko czynnik może mieć zarówno wartość predykcyjną, jak i prognostyczną. Czynniki prognostyczne dla pacjentów z rakiem jelita grubego możemy podzielić na te związane z nowotworem, pacjentem oraz z samym leczeniem. Jednym z najważniejszych parametrów ocenianych w trakcie diagnostyki jest stadium zaawansowania choroby. Najogólniej chorobę możemy podzielić na zlokalizowaną, w której rak nie rozprzestrzenił się poza pierwotnego guza, regionalną, w której komórki nowotworowe zajmują okoliczne tkanki lub węzły chłonne oraz rozsianą, kiedy choroba rozprzestrzeniła się do organów odległych, jak np. wątroba czy płuca. Analizy przeprowadzone na podstawie amerykańskiej bazy danych SEER (z ang. Surveillance, Epidemiology, and End Results) wskazują na 5-letnie przeżycie równe 91,5% dla choroby zlokalizowanej, 74,6% dla choroby regionalnej oraz 16,2% dla choroby rozsianej (10). W praktyce klinicznej oceniamy stadium zaawansowania na podstawie klasyfikacji TNM (ang. Tumor-Node–Metastasis), którą zajmiemy się szczegółowo w następnej części artykułu.
Kolejnym parametrem mającym wpływ na przeżycie jest lokalizacja nowotworu. Jelito grube składa się z kątnicy, okrężnicy (wstępująca, poprzeczna, zstępująca, esica) oraz odbytnicy. Badania przeprowadzane w ostatnich latach analizowały czy umiejscowienie guza pierwotnego wpływa na rokowanie pacjentów z rakiem jelita grubego. Nowotwór może być zlokalizowany w prawej części jelita grubego (obejmującej kątnicę, okrężnicę wstępującą oraz początkowy odcinek okrężnicy poprzecznej), w lewej części jelita grubego (pozostała część okrężnicy poprzecznej, okrężnica zstępująca oraz esica) lub w odbytnicy. W badaniu angielskim, w którym włączono niemal 168 tysięcy pacjentów z rakiem jelita grubego, badacze wykazali, że 5-letnie przeżycie było najniższe w grupie pacjentów z rakiem prawostronnym (55,6%). Lepsze wyniki obserwowano u pacjentów z guzem zlokalizowanym w lewej części jelita (64,6%) oraz w odbytnicy (68,7%) (11).
Inne czynniki związane z nowotworem dotyczą charakteru genetycznego i molekularnego tkanki guza. Poza wpływem na przeżycie, takie czynniki w znaczny sposób wpływają na decyzję dotyczącą rodzaju leczenia onkologicznego. W raku jelita grubego jednym z takich parametrów jest niestabilność mikrosatelitarna (MSI). Wywołana jest przez mutacje w systemie odpowiedzialnym za naprawę cząsteczek DNA. Aktualne dane literaturowe wskazują, że stwierdzenie niestabilności mikrosatelitarnej jest związane z lepszym rokowaniem u pacjentów z chorobą bez obecności przerzutów (12). Mutacje w genach RAS i BRAF są z kolei uznawane jako negatywne markery prognostyczne związane z krótszymi wskaźnikami przeżycia (13).
Czynniki związane z pacjentem obejmują takie parametry jak wiek, płeć, styl życia czy choroby współistniejące. Pomimo tego, że starszy wiek wydaje się powiązany z gorszym rokowaniem, wyniki ostatnich badań pokazują nam co innego. Podeszły wiek związany jest z występowaniem chorób współistniejących, co przekłada się na gorszy stan zdrowia. Nie jest on natomiast niezależnym czynnikiem ryzyka związanym z krótszym przeżyciem u pacjentów z rakiem jelita grubego (14, 15). W tym miejscu należy wspomnieć o niepokojącym trendzie wzrostu częstości występowania raka jelita grubego o wczesnym początku, czyli zdiagnozowanego przed 50 rokiem życia (16). Alarmujące są także wyniki badań, które mówią o bardziej agresywnym stadium choroby w momencie rozpoznania w tej grupie pacjentów (17). Ponadto wiemy, że mężczyźni z rakiem jelita grubego o wczesnym początku charakteryzują się gorszym rokowaniem od kobiet (18).
Kolejnym istotnym parametrem znacznie wpływającym na długość życia jest stopień odżywienia.
Niedobory żywieniowe prowadzą do takich stanów jak sarkopenia (degradacja mięśni) oraz kacheksja, czyli ogólne wyniszczenie organizmu. Wiemy, że sarkopenia związana jest z gorszym przeżyciem pacjentów z rakiem jelita grubego (19). U pacjentów leczonych chirurgicznie, utrata masy mięśniowej zwiększa także ryzyko występowania powikłań (20).
Lecząc pacjenta onkologicznego, musimy skupić się na jego całościowym dobrostanie. Niezwykle ważne jest, aby choroby współistniejące były odpowiednio leczone. Poza korzyściami dla zdrowia wynikającymi z samego leczenia tych schorzeń, mają one także wpływ na choroby nowotworowe. Analiza przeżycia pacjentów z rakiem jelita grubego, u których stwierdzono cukrzycę, nadwagę oraz nadciśnienie tętnicze wykazała znaczne gorsze rokowanie w porównaniu do pacjentów bez tych chorób współistniejących (21). W przypadku cukrzycy, zaobserwowano istotny wpływ leczenia choroby na dłuższe przeżycie u pacjentów z rakiem jelita grubego (22).
Kolejne ważne czynniki wpływające na długość życia dotyczą samego leczenia onkologicznego. U pacjentów leczonych chirurgicznie, doszczętność zabiegu ma kluczowe znaczenie dla rokowania (23). W przypadku pacjentów leczonych systemowo, dostęp do nowoczesnych terapii rekomendowanych w najnowszych wytycznych związany jest z większym prawdopodobieństwem pozytywnej odpowiedzi na zastosowane leczenie.
Nomogramy w ocenie rokowania
Mnogość czynników wpływających na długość życia sprawia, że analiza przeżycia jest skomplikowanym procesem. W celu ułatwienia oceny rokowania powstały narzędzia znane jako nomogramy. Są to wykresy, które biorą pod uwagę wybrane czynniki i przedstawiają prawdopodobieństwo przeżycia (24, 25). Na rycinie 1 przedstawiono przykładowy nomogram, który ocenia prawdopodobieństwo przeżycia pacjentów z rakiem jelita grubego, mających ponad 70 lat.
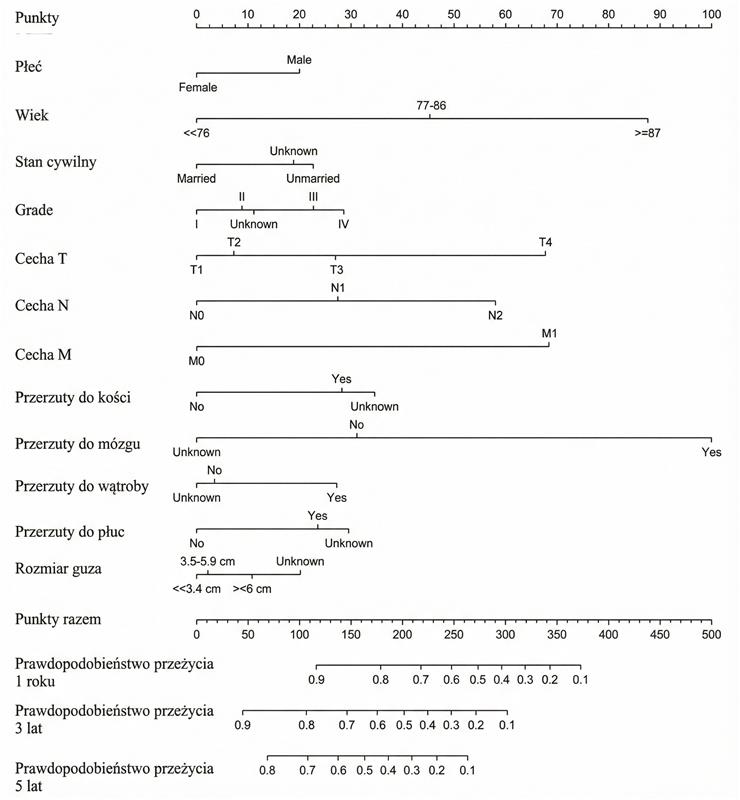
Rycina 1. Nomogram określający prawdopodobieństwo przeżycia pacjentów z rakiem jelita grubego starszych niż 70 lat. Rycina opracowana przez (24), przetłumaczona. Wykorzystano na podstawie licencji CC BY 4.0. https://creativecommons.org/licenses/by/4.0/
Stadium zaawansowania nowotworu jako kluczowy czynnik rokowniczy
W poprzednim fragmencie wspominaliśmy o kluczowej roli stadium zaawansowania w rokowaniu pacjentów z rakiem jelita grubego. W praktyce klinicznej zaawansowanie choroby określamy na podstawie klasyfikacji TNM. Cecha „T” wskazuje na głębokość nacieku guza pierwotnego, „N” informuje nas o przerzutach do węzłów chłonnych, natomiast cecha „M” o przerzutach odległych. Ocena skali TNM przekłada się na stopień zaawansowania choroby. Obecnie wyróżniamy 4 główne stadia (I, II, III, IV), które dzielą się na następne podgrupy. Analizy przeprowadzone na podstawie europejskich baz danych wskazują, że prawdopodobieństwo 5-letniego przeżycia pacjentów w I stadium choroby wynosi ponad 90%. W II i III stadium przeżycie wynosi odpowiednio około 80-90% oraz 60-75%. W IV stopniu zaawansowania 5-letnie przeżycie szacuje się na około 15% (26). Należy przy tym pamiętać, że opisywane wartości są szacunkowe i zostały określone na podstawie pacjentów diagnozowanych i leczonych kilka, a nawet kilkanaście lat temu. Onkologia jest dziedziną bardzo intensywnie rozwijającą się, co przekłada się na wprowadzanie coraz nowszych metod leczenia.
Ramka 2. Stopień zaawansowania klinicznego a skala TNM.
Metody leczenia raka jelita grubego i ich wpływ na rokowania
Pacjenci z rakiem jelita grubego mogą być leczeni chirurgicznie, przy użyciu radioterapii lub za pomocą leczenia systemowego. Rodzaj leczenia zależy od stopnia zaawansowania oraz lokalizacji guza, a jego właściwy dobór jest kluczowy dla zapewnienia największej szansy pozytywnej odpowiedzi. Leczenie chirurgiczne jest podstawową metodą leczenia pacjentów we wczesnym stadium zaawansowania. Celem leczenia jest usunięcie całego guza pierwotnego razem z marginesem zdrowych tkanek. Poza usunięciem guza, powinna zostać przeprowadzona także limfadenektomia, czyli procedura usunięcia węzłów chłonnych. Aktualne wytyczne wskazują na konieczność usunięcia co najmniej 12 węzłów chłonnych, aby prawidłowo ocenić stadium zaawansowania. Dotychczas przeprowadzone badania wykazały, że poszerzenie zakresu limfadenektomii u pacjentów z prawostronnym rakiem jelita grubego nie ma wpływu na 3-letnie przeżycie (27). Niemniej, wyniki meta-analizy przeprowadzonej przez De Lange i współautorów wskazują na pozytywny wpływ poszerzenia zabiegu na przeżycie 5-letnie (28).
Leczenie systemowe obejmuje chemioterapię, immunoterapię oraz leczenie celowane. W raku jelita grubego, leczenie systemowe stosuje się jako leczenie pooperacyjne (zwane także leczeniem adjuwantowym) lub w leczeniu paliatywnym. Leczenie adjuwantowe ma na celu zmniejszenie ryzyka nawrotu raka jelita grubego po leczeniu chirurgicznym. Stosuje się je u pacjentów w III stadium zaawansowania oraz u wybranych pacjentów w stadium II. Używane protokoły wykorzystują takie leki jak 5-fluorouracyl lub kapecytabina w połączeniu z oxaliplatyną (29).
Leczenie paliatywne stosuje się u pacjentów z zaawansowaną chorobą, w której nie uzyskamy korzyści z leczenia chirurgicznego. Celem leczenia jest ograniczenie rozwoju choroby i poprawa jakości życia. Arsenał leków dostępnych w nieoperacyjnym raku jelita grubego jest rozbudowany i obejmuje chemioterapię opartą na 5-fluorouracylu, leczenie celowane za pomocą leków anty-EGFR (śródnabłonkowy czynnik wzrostu), inhibitorów BRAF lub VEGF (naczyniowy czynnik wzrostu), czy immunoterapię. Przy planowaniu leczenia pacjentów z nieoperacyjnym rakiem jelita grubego niezbędna jest kompleksowa analiza genetyczna i molekularna nowotworu, ponieważ od nich zależą nasze możliwości terapeutyczne. Leczenie paliatywne prowadzi się w sposób ciągły, regularnie podając następne cykle leczenia oraz oceniając odpowiedź na terapię. W przypadku stwierdzenia progresji choroby nowotworowej, konieczna jest zmiana protokołu leczenia.
U pacjentów z nieoperacyjnym rakiem jelita grubego poza chemioterapią możemy zastosować immunoterapię lub leczenie celowane. Immunoterapia stanowi kluczowy element nowoczesnego leczenia onkologicznego. Jej mechanizm działania zasadniczo różni się od efektów wywoływanych przez chemioterapię, w której to podawane cytostatyki działają na wszystkie szybko dzielące się komórki naszego organizmu. W przypadku immunoterapii, głównym celem leczenia jest stymulowanie własnych komórek odpornościowych do walki z nowotworem. Immunoterapię stosujemy w codziennej praktyce klinicznej w leczeniu takich nowotworów jak czerniak, rak żołądka czy raka płuca. W raku jelita grubego immunoterapię możemy zastosować tylko u pacjentów z wysoką niestabilnością mikrosatelitarną lub zaburzeniami mechanizmów naprawy uszkodzeń DNA o typie niedopasowania. Dostępne terapie w tej grupie obejmują pembrolizumab lub kombinację nivolumabu z ipilimumabem. Pembrolizumab może być wykorzystany w leczeniu zaawansowanego raka jelita grubego w pierwszej linii leczenia. Badanie kliniczne KEYNOTE-177 wykazało istotnie dłuższy czas wolny od progresji u pacjentów leczonych immunoterapią w porównaniu do chemioterapii (mediana 16.5 miesiąca vs 8.2 miesiąca). Trzyletnie przeżycie wolne od progresji również było większe w grupie z immunoterapią (42,3% vs 11,1%) (30). Oznacza to, że pembrolizumab jest znacznie bardziej efektywny w ograniczeniu rozwoju choroby od chemioterapii. Połączone zastosowanie nivolumabu z ipilimumabem stosujemy w drugiej lub w kolejnych liniach leczenia. Badanie kliniczne III fazy również potwierdziło przewagę podwójnej immunoterapii nad chemioterapią w wydłużaniu czasu wolnego od progresji (31).
Leczenie celowane zyskuje coraz większą rolę we współczesnej onkologii. Dostępne terapie stosowane u pacjentów z rakiem jelita grubego obejmują między innymi inhibitory EGFR, takie jak cetuksymab i panitumumab, inhibitory VEGF (bevacizumab, frukwintynib) czy inhibitor BRAF (encorafenib). Ich mechanizm działania opiera się na precyzyjnym atakowaniu cząsteczek związanych z procesem nowotworowym. Przykładowo, VEGF jest cząsteczką, która stymuluje rozwój nowych naczyń krwionośnych. Nowotwory złośliwe zbudowane są z komórek o dużej aktywności metabolicznej, wymagającej dostarczenia tlenu oraz składników odżywczych, aby mogły się rozwijać i dzielić. Nowotwory tworzą siatkę naczyń krwionośnych, za pomocą których komórki uzyskują niezbędne składniki. Hamowanie działania VEGF ma na celu zatrzymanie tego procesu, co uniemożliwi komórkom nowotworowym dalszy rozwój. Wykazano, że zablokowanie tej ścieżki jest związane z pozytywnymi efektami nawet u pacjentów z niepomyślnym rokowaniem. Nasze doświadczenie kliniczne sugeruje, że pacjenci leczeni wieloma liniami leczenia systemowego charakteryzują się gorszym rokowaniem i mniejszą szansą na odpowiedź na kolejne leczenie. Mimo to zastosowanie frukwintynibu związane było z istotną korzyścią w przeżyciu w porównaniu z placebo (32). Lek ten możemy zastosować w trzeciej lub w kolejnych liniach leczenia.
Jakość życia pacjentów z rakiem jelita grubego
Wraz z rozwojem naukowym, który prowadzi do rejestracji nowych terapii oraz wydłużania życia pacjentów onkologicznych, równie istotne jest skupienie się na jakości życia. Rak jelita grubego oraz stosowane metody leczenia mogą prowadzić do pogorszenia jakości życia. W przypadku pacjentów z nowotworem operacyjnym, prawidłowe leczenie może wymagać wyłonienia stomii, czyli stworzenia sztucznej drogi oddawania stolca, która wiąże się z pogorszeniem jakości życia (33). Jednakże, wyniki badań wskazują, że im więcej czasu minęło od wyłonienia stomii, tym pacjenci wykazywali lepsze samopoczucie, mniejszy lęk i bezradność (34).
Leczenie systemowe związane jest z regularnymi wizytami w szpitalu oraz z działaniami niepożądanymi stosowanych leków. W przypadku szeroko stosowanego 5-fluorouracylu, działania niepożądane obejmują między innymi zaburzenia funkcji szpiku kostnego, co może prowadzić do zmniejszenia ilości krwinek białych oraz wystąpienia zakażeń, zapalenia błon śluzowych, biegunek, nudności i wymiotów czy powikłań kardiologicznych (35). 5-fluorouracyl stosuje się często z oxaliplatyną, która może wywoływać zaburzenia układu nerwowego znane jako polineuropatia. Objawia się jako uczucie mrowienia lub drętwienia, która może prowadzić do pogorszenia funkcjonalności ruchowej (36). Kolejnym lekiem często stosowanym z 5-fluorouracylem jest irynotekan, którego charakterystycznym działaniem niepożądanym jest zespół cholinergiczny (37), mogący się objawiać nadmierną potliwością, łzawieniem, biegunką lub zwolnieniem czynności pracy serca. Stosując powyższe leki w codziennej praktyce klinicznej, staramy się minimalizować ryzyko wystąpienia działań niepożądanych. Chemioterapia zazwyczaj podawana jest razem z leczeniem osłonowym, które ma na celu ograniczyć reakcje nadwrażliwości czy nudności. W przypadku wystąpienia działań niepożądanych, możemy modyfikować dawkę chemioterapii lub zaproponować odpowiednie leczenie.
Kolejnym aspektem jakości życia niewątpliwie jest zdrowie psychiczne. Wiemy, że u pacjentów z rakiem jelita grubego występuje zwiększone ryzyko rozwoju depresji (38). Choroba jest także niezwykle trudnym doświadczeniem dla najbliższych pacjenta. Możemy spotkać się z określeniem, że choruje nie sam pacjent, ale cała rodzina. Pamiętajmy, że na oddziałach onkologicznych często dostępne jest wsparcie psychologiczne i psychiatryczne, które służy dobru pacjenta i jego rodziny. Skorzystanie z opieki psychologicznej może pomóc lepiej zrozumieć doświadczane emocje oraz wesprzeć w akceptacji i adaptacji do zmian.
Profilaktyka i wczesne wykrywanie a szanse na długie przeżycie
Profilaktyka to podejmowanie działań, które mają na celu zapobieganie pojawieniu się lub rozwojowi zaburzeń, chorób lub innych niekorzystnych zjawisk społecznych. Wśród czynników ryzyka wystąpienia raka jelita grubego wyróżniamy te niemodyfikowalne i modyfikowalne. Do pierwszej grupy należą takie czynniki jak płeć, wiek czy obecność wrodzonych mutacji. W drugiej grupie znajduje się szeroko rozumiany styl życia.
Płeć męska, starszy wiek, rozpoznanie zespołu Lyncha czy rodzinnej polipowatości gruczolakowatej oraz obecność chorób zapalnych jelit stanowią niemodyfikowalne czynniki ryzyka rozwoju raka jelita grubego (39). Do drugiej grupy należą otyłość, spożywanie alkoholu, palenie papierosów oraz niewłaściwa dieta bogata w czerwone i przetworzone mięso (40-42). Dieta bogata w błonnik z kolei zmniejsza ryzyko wystąpienia choroby (43, 44). Pamiętajmy, że nasze decyzje dotyczące stylu życia realnie wpływają na ryzyko rozwoju raka jelita grubego.
Drugim kluczowym elementem profilaktyki jest wykrycie choroby na jej wczesnym etapie. Stadium zaawansowania raka jest kluczowym czynnikiem wpływającym na długość życia. Rak jelita grubego objęty jest w Polsce programem badań przesiewowych. Pacjenci w wieku 50-65 lat bez objawów raka jelita grubego mogą wykonać kolonoskopię w ramach programu finansowanego przez Narodowy Fundusz Zdrowia raz na 10 lat. W związku z genetycznymi predyspozycjami do wystąpienia choroby, program jest także dostępny dla osób w wieku 40-49 lat, jeżeli u ich krewnych pierwszego stopnia rozpoznano nowotwór jelita grubego. W badaniu przeprowadzonym w Polsce, Norwegii i Szwecji wykazano, że profilaktyczna kolonoskopia nie służy jedynie wcześniejszemu wykryciu choroby, ale także może zmniejszać ryzyko rozwoju raka jelita grubego. Usuwanie polipów w trakcie zabiegu zapobiega ich przekształceniu w nowotwór złośliwy, co przełożyło się na mniejsze ryzyko rozwoju raka w omawianym badaniu (45). Drugim badaniem, które pośrednio może wskazywać na obecność raka jelita grubego jest test na obecność krwi utajonej w kale. Warto w tym miejscu zaznaczyć, że rak jelita grubego może rozwijać się bezobjawowo, co sprawia, że tylko testy przesiewowe pozwolą na diagnozę choroby. Wiemy, że pacjenci z bezobjawową chorobą wykrytą za pomocą testu przesiewowego mają lepsze rokowanie w porównaniu do tych, u których diagnoza była postawiona po rozwinięciu przez nich objawów choroby (46).
Podsumowując, rak jelita grubego jest chorobą o poważnym rokowaniu, która w znaczny sposób wpływa na jakość życia. Niewątpliwie najważniejszym czynnikiem wpływającym na długość życia jest stadium zaawansowania. Badania profilaktyczne pozwalają na diagnozę choroby u pacjentów bezobjawowych oraz na jej wczesnym etapie, co przekłada się na korzystne rokowanie. Poza zaawansowaniem choroby, istnieje szereg czynników, które w istotny sposób wpływają na oczekiwaną długość życia, w tym lokalizacja i charakter molekularny nowotworu, płeć, obecność chorób przewlekłych czy stopień odżywienia. W przypadku pacjentów w czwartym stopniu zaawansowania klinicznego, obecne metody leczenia pozwalają w istotny sposób na ograniczenie rozwoju choroby i poprawę jego długości i jakości. Ciągły postęp w onkologii, przekładający się na częste aktualizacje wytycznych sprawia, że spodziewamy się dalszych postępów w leczeniu pacjentów z rakiem jelita grubego.
Referencje:
- Bray F, Laversanne M, Sung H, Ferlay J, Siegel RL, Soerjomataram I, et al.Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2024;74(3):229-63.
- https://onkologia.pacjent.gov.pl/pl/kompendium-chorob-nowotworowych/jelito-grube/epidemiologia, data dostępu: 11/2025
- Wagle NS, Nogueira L, Devasia TP, Mariotto AB, Yabroff KR, Islami F, et al. Cancer treatment and survivorship statistics, 2025. CA Cancer J Clin. 2025;75(4):308-40.
- Santucci C, Mignozzi S, Levi F, Malvezzi M, Boffetta P, Negri E, et al. European cancer mortality predictions for the year 2025 with focus on breast cancer. Ann Oncol. 2025;36(4):460-8.
- Matsuda T, Fujimoto A, Igarashi Y. Colorectal Cancer: Epidemiology, Risk Factors, and Public Health Strategies. Digestion. 2025;106(2):91-9.
- Hanahan D. Hallmarks of Cancer: New Dimensions. Cancer Discov. 2022;12(1):31-46.
- Jain AK, Parikh PM, Dadhich SC, Arora A, Kumar M, Ranjan P, et al. Familial Polyposis and Colon Cancer. South Asian J Cancer. 2024;13(4):305-8.
- https://onkologia.org.pl/pl/raporty, data dostępu: 11/2025
- Narodowy Instytut Onkologii im. Marii Skłodowskiej-Curie – Państwowy Instytut Badawczy, we współpracy z Ministerstwem Zdrowia oraz Narodowym Funduszem Zdrowia. Raport otwarcia Narodowej Strategii Onkologicznej 2021 https://onkologia.pacjent.gov.pl/pl/narodowa-strategia-onkologiczna/raport-otwarcia-narodowej-strategii-onkologicznej
- https://seer.cancer.gov/statfacts/html/colorect.html,data dostępu: 11/2025
- Hodges N, Mackenzie H, D’Souza N, Brown G, Miskovic D. Survival outcomes for right-versus left-sided colon cancer and rectal cancer in England: A propensity-score matched population-based cohort study. Eur J Surg Oncol. 2022;48(4):841-9.
- Taieb J, Svrcek M, Cohen R, Basile D, Tougeron D, Phelip JM. Deficient mismatch repair/microsatellite unstable colorectal cancer: Diagnosis, prognosis and treatment. Eur J Cancer. 2022;175:136-57.
- Tang W, Liu Y, Ji M, Liu T, Chen Y, Zhuang A, et al. Association of RAS/BRAF Status and Prognosis of Metastatic Colorectal Cancer: Analysis of 1002 Consecutive Cases. Ann Surg Oncol. 2022;29(6):3593-603.
- Oh BY, Huh JW, Kim HC, Park YA, Cho YB, Yun SH, et al. Oncologic outcome of colorectal cancer patients over age 80: a propensity score-matched analysis. Int J Colorectal Dis. 2018;33(8):1011-8.
- Toquero P, Mondejar R, Romero-Laorden N, Mendez E, Castillo L, Hernandez Marin B, et al. Is Older Age an Independent Prognostic Factor of Survival in Metastatic Colorectal Cancer? Oncology. 2024;102(9):747-58.
- Akimoto N, Ugai T, Zhong R, Hamada T, Fujiyoshi K, Giannakis M, et al. Rising incidence of early-onset colorectal cancer – a call to action. Nat Rev Clin Oncol. 2021;18(4):230-43.
- Carbone F, Spinelli A, Ciardiello D, Realis Luc M, de Pascale S, Bertani E, et al. Prognosis of early-onset versus late-onset sporadic colorectal cancer: Systematic review and meta-analysis. Eur J Cancer. 2025;215:115172.
- Afify AY, Ashry MH, Hassan H. Sex differences in survival outcomes of early-onset colorectal cancer. Sci Rep. 2024;14(1):22041.
- Lin WL, Nguyen TH, Huang WT, Guo HR, Wu LM. Sarcopenia and survival in colorectal cancer without distant metastasis: a systematic review and meta-analysis. J Gastroenterol Hepatol. 2024;39(11):2250-9.
- Wang J, Chen Y, He J, Yin C, Xie M. Sarcopenia Predicts Postoperative Complications and Survival of Colorectal Cancer Patients Undergoing Radical Surgery. Br J Hosp Med (Lond). 2024;85(9):1-17.
- Ottaiano A, Santorsola M, Circelli L, Perri F, Cascella M, Sabbatino F, et al. Hypertension, type 2 diabetes, obesity, and p53 mutations negatively correlate with metastatic colorectal cancer patients’ survival. Front Med (Lausanne). 2023;10:1091634.
- Peng F, Hu D, Lin X, Liang B, Chen Y, Zhang H, et al. Impact of long-term antihypertensive and antidiabetic medications on the prognosis of post-surgical colorectal cancer: the Fujian prospective investigation of cancer (FIESTA) study. Aging (Albany NY). 2018;10(5):1166-81.
- Bhangu A, Ali SM, Darzi A, Brown G, Tekkis P. Meta-analysis of survival based on resection margin status following surgery for recurrent rectal cancer. Colorectal Dis. 2012;14(12):1457-66.
- Yu C, Zhang Y. Establishment of prognostic nomogram for elderly colorectal cancer patients: a SEER database analysis. BMC Gastroenterol. 2020;20(1):347.
- Li YX, Mu BX, Zhou HJ, Qian J, Zhou JY, Chen M. Development and validation of nomograms for predicting overall survival and cancer-specific survival in unresected colorectal cancer patients undergoing chemotherapy. Sci Rep. 2025;15(1):12477.
- Bouvier AM, Jooste V, Lillini R, Marcos-Gragera R, Katalinic A, Giorgi Rossi P, et al. Differences in survival and recurrence of colorectal cancer by stage across population-based European registries. Int J Cancer. 2024;155(5):807-15.
- Lu J, Xing J, Zang L, Zhang C, Xu L, Zhang G, et al. Extent of Lymphadenectomy for Surgical Management of Right-Sided Colon Cancer: The Randomized Phase III RELARC Trial. J Clin Oncol. 2024;42(33):3957-66.
- De Lange G, Davies J, Toso C, Meurette G, Ris F, Meyer J. Complete mesocolic excision for right hemicolectomy: an updated systematic review and meta-analysis. Tech Coloproctol. 2023;27(11):979-93.
- Argiles G, Tabernero J, Labianca R, Hochhauser D, Salazar R, Iveson T, et al. Localised colon cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2020;31(10):1291-305.
- Diaz LA, Jr., Shiu KK, Kim TW, Jensen BV, Jensen LH, Punt C, et al. Pembrolizumab versus chemotherapy for microsatellite instability-high or mismatch repair-deficient metastatic colorectal cancer (KEYNOTE-177): final analysis of a randomised, open-label, phase 3 study. Lancet Oncol. 2022;23(5):659-70.
- Andre T, Elez E, Van Cutsem E, Jensen LH, Bennouna J, Mendez G, et al. Nivolumab plus Ipilimumab in Microsatellite-Instability-High Metastatic Colorectal Cancer. N Engl J Med. 2024;391(21):2014-26.
- Dasari A, Lonardi S, Garcia-Carbonero R, Elez E, Yoshino T, Sobrero A, et al. Fruquintinib versus placebo in patients with refractory metastatic colorectal cancer (FRESCO-2): an international, multicentre, randomised, double-blind, phase 3 study. Lancet. 2023;402(10395):41-53.
- Robitaille S, Maalouf MF, Penta R, Joshua TG, Liberman AS, Fiore JF, Jr., et al. The impact of restorative proctectomy versus permanent colostomy on health-related quality of life after rectal cancer surgery using the patient-generated index. Surgery. 2023;174(4):813-8.
- Dziedzic B, Sienkiewicz Z, Leńczuk-Gruba A, Idzik A, Fidecki W, Wysokiński M. The quality of life of patients with an intestinal stoma. Pielęgniarstwo Chirurgiczne i Angiologiczne/Surgical and Vascular Nursing. 2019;13(3):100-6.
- Zhao R, Han M, Lin S, Lin Z, Yu M, Zhang B, et al. Adverse drug events associated with fluorouracil use in patients with metastatic colorectal cancer: a real-world pharmacovigilance study based on the FDA adverse event reporting system. Expert Opin Drug Saf. 2024;23(10):1295-307.
- Pan X, Xiao X, Ding Y, Shu Y, Zhang W, Huang L. Neurological adverse events associated with oxaliplatin: A pharmacovigilance analysis based on FDA adverse event reporting system. Front Pharmacol. 2024;15:1431579.
- Kanbayashi Y, Ishikawa T, Kanazawa M, Nakajima Y, Tabuchi Y, Kawano R, et al. Predictive factors for the development of irinotecan-related cholinergic syndrome using ordered logistic regression analysis. Med Oncol. 2018;35(6):82.
- Cheng V, Oveisi N, McTaggart-Cowan H, Loree JM, Murphy RA, De Vera MA. Colorectal Cancer and Onset of Anxiety and Depression: A Systematic Review and Meta-Analysis. Curr Oncol. 2022;29(11):8751-66.
- Ionescu VA, Gheorghe G, Bacalbasa N, Chiotoroiu AL, Diaconu C. Colorectal Cancer: From Risk Factors to Oncogenesis. Medicina (Kaunas). 2023;59(9).
- Ungvari Z, Fekete M, Varga P, Lehoczki A, Fekete JT, Ungvari A, et al. Overweight and obesity significantly increase colorectal cancer risk: a meta-analysis of 66 studies revealing a 25-57% elevation in risk. Geroscience. 2025;47(3):3343-64.
- Tsukanov VV, Vasyutin AV, Tonkikh JL. Risk factors, prevention and screening of colorectal cancer: A rising problem. World J Gastroenterol. 2025;31(5):98629.
- Gram IT, Park SY, Wilkens LR, Haiman CA, Le Marchand L. Smoking-Related Risks of Colorectal Cancer by Anatomical Subsite and Sex. Am J Epidemiol. 2020;189(6):543-53.
- Zhou E, Rifkin S. Colorectal Cancer and Diet: Risk Versus Prevention, Is Diet an Intervention? Gastroenterol Clin North Am. 2021;50(1):101-11.
- Arayici ME, Mert-Ozupek N, Yalcin F, Basbinar Y, Ellidokuz H. Soluble and Insoluble Dietary Fiber Consumption and Colorectal Cancer Risk: A Systematic Review and Meta-Analysis. Nutr Cancer. 2022;74(7):2412-25.
- Bretthauer M, Loberg M, Wieszczy P, Kalager M, Emilsson L, Garborg K, et al. Effect of Colonoscopy Screening on Risks of Colorectal Cancer and Related Death. N Engl J Med. 2022;387(17):1547-56.
- Brenner H, Jansen L, Ulrich A, Chang-Claude J, Hoffmeister M. Survival of patients with symptom- and screening-detected colorectal cancer.Oncotarget. 2016;7(28):44695-704.








